Qual a diferença entre absorção e adsorção? Tratam-se de fenômenos diferentes, com princípios distintos.
![]()
Moléculas e átomos podem fixar-se a superfícies por dois processos - fisiosorção e quimiosorção.
Na fisiosorção (uma
abreviação de “adsorção física”), ocorre uma interação de Van der
Waals entre o adsorbato e o substrato. Existe uma faixa larga de Interações de
Van der Waals, mas que são fracas e a energia liberada quando uma partícula é
fisicamente adsorvida é da mesma ordem de magnitude da entalpia de condensação.
Esta energia pode ser absorvida como vibração do retículo e dissipada
termicamente; uma molécula agitando-se sobre a superfície irá perder esta
energia gradualmente e finalmente será adsorvida, num processo denominado
acomodação. A entalpia de fisiosorção pode ser medida pelo monitoramento da
elevação da temperatura de uma amostra de capacidade calorífica conhecida.
Valores típicos são da ordem de 20kJ mol-1. Esta variação pequena
de entalpia não é suficiente para quebrar ligações e, assim, uma molécula
fisiosorvida mantém suas características, apesar da possibilidade de estar
distorcida devido à presença da superfície.
Na quimiosorção (uma abreviação
de adsorção química) as moléculas ou átomos fixam-se à superfície pela
formação de uma ligação química, normalmente covalente, e tendem a
encontrar locais que maximizem seu número de coordenação. A entalpia de adsorção
é muito maior que na fisiosorção; valores típicos encontram-se na faixa de
200kJ mol-1. A distância entre a superfície e o átomo adsorvido
mais próximo também é tipicamente menor na quimiosorção que na fisiosorção.
Uma molécula quimiosorvida pode se fragmentar devido à demanda por valências
não satisfeitas dos átomos superficiais, e a existência desses fragmentos é
uma das razões pelas quais superfícies sólidas catalisam reações.
Exceto em casos especiais, a
quimiosorção deve ser exotérmica. Um processo espontâneo requer variação
da energia livre de Gibbs (dG) menor que zero. Devido à liberdade translacional
do adsorbato ser reduzida quando é adsorvida, dS (a variação da entropia) é
negativo. Deste modo, para que dG=dH-TdS
seja negativo, dH
deve ser menor que zero – isto é, o processo é exotérmico. Exceções podem
ocorrer se o adsorbato dissociar-se e possuir alta mobilidade translacional na
superfície.
A melhor forma para distinguir
entre quimiosorção e fisiosorção é através da entalpia de adsorção.
Valores mais negativos que –25kJ mol-1 são tidos como característicos
de fisiosorção enquanto que valores mais negativos que cerca de –40kJ mol-1
são tomados como típicos de quimiosorção. Entretanto, este critério não é
absoluto e técnicas espectroscópicas que identificam as espécies adsorvidas
podem ser utilizadas.
As moléculas em solução e
adsorvidas estão em um equilíbrio dinâmico, e a fração da superfície do
adsorvente coberta pelo substrato (q)
depende da concentração deste último (equação 1). A variação de
q com a concentração a uma dada temperatura é denominada
isoterma de adsorção.
![]() (1)
(1)
A isoterma mais simples e
fisicamente plausível, proposta por Langmuir e que leva seu nome, é baseada em
três premissas:
| A adsorção
não pode prosseguir além de uma única camada (monocamada); | |
| Todos os sítios
são equivalentes e a superfície é uniforme (isto é, a superfície é
perfeitamente uniforme numa escala microscópica); | |
| A
habilidade de uma molécula se fixar à superfície independe da ocupação
dos sítios visinhos. |
O equilíbrio dinâmico no sistema é dado por [1]:
![]()
Com constantes de velocidade ka
para adsorção e kd
para desorção. A
velocidade de alteração da cobertura superficial, dq/dt,
devido à adsorção é proporcional à concentração do substrato “A” e do
número de sítios livres, N(1 - q),
onde N é o número total de sítios:
![]() (2)
(2)
A velocidade de alteração de
q
devido a desorção é proporcional ao número de espécies adsorvidas, Nq:
![]() (3)
(3)
No equilíbrio não há alteração
resultante (isto é, a somatória destas duas velocidades é zero) e a solução
para q
fornece a isoterma de Langmuir:
![]()
![]() (4)
(4)
A isoterma de Langmuir (equação 4) pode ser re-escrita da seguinte maneira:
![]() (5)
(5)
Onde x é a quantidade de substrato adsorvido por unidade de massa do adsorvente, xm é a quantidade limite de substrato que pode ser adsorvido por unidade de massa de adsrovente, K é a constante de equilíbrio, conforme equação (4) e c é a concentração do soluto na solução em equilíbrio com o adsorvente. A equação (6) mostra que o gráfico de 1/x por 1/c fornece uma reta de coeficiente angular 1/xm.K e coeficiente linear 1/xm.
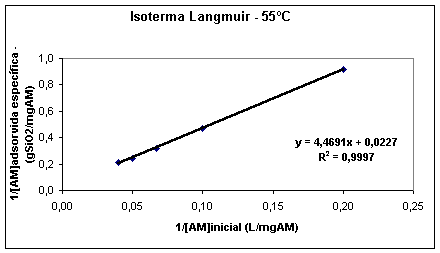
Figura 1 - Exemplo de gráfico para obtenção dos parâmetros de Langmuir.
A quantidade limite de saturação do substrato e os parâmetros de equilíbrio são de suma importância na definição da capacidade adsortiva de um possível agente adsorvente e são utilizados para definição sobre qual o adsorvente mais indicado para um determinado substrato.
A fração superficial coberta
aumenta com a concentração de substrato, aproximando-se de um apenas quando
esta concentração for muito alta e, assim, as moléculas de substrato são forçadas
a ocupar quaisquer sítios desocupados do adsorvente. Curvas diferentes (e por
conseqüência diferentes valores de K) são obtidos sob diferentes
temperaturas e, assim, a dependência de K com a temperatura pode ser
utilizada para determinar a entalpia de adsorção isostérica, dadq,
a entalpia de adsorção padrão a uma dada cobertura de superfície. Para
determinar esta grandeza deve-se partir do princípio de que K é
essencialmente uma constante de equilíbrio, e então utilizar a equação de Van’t
Hoff na forma:
![]() (6)
(6)
Para determinar a entalpia de adsorção, a equação de Van’t Hoff (6) pode
ser re-escrita na seguinte forma:
![]() (8)
(8)
Pois:
![]() (9)
(9)
Nota-se pela equação (8) que o gráfico de lnK por 1/T, em Kelvin,
fornece um reta de coeficiente angular q/R.
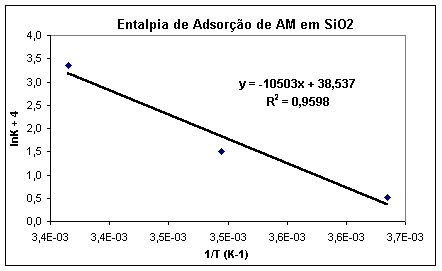
Figura 2 – Exemplo de gráfico para determinação da entalpia de adsorção, segundo isoterma de Langmuir.
Existem ainda outros tipos de isotermas, normalmente utilizadas quando as premissas da isoterma de Langmuir não satisfazem as condições reais do sistema. Exemplos são a isoterma BET (Brunauer, Emmet, Teller), e isoterma de Temkin e a isoterma de Freundlich.
Exemplos de adsorventes são o carvão ativo, a sílica (SiO2), o óxido de alumínio (Al2O3) e os zeólitos.
A.Krell