| Introdução | |
| Histórico | |
| Propriedades das Ligações Químicas | |
| A Tabela Periódica | |
| Evidências Adicionais da Existência dos Átomos | |
| Estrutura Molecular | |
| A Estrutura Interna dos Átomos |
![]()
Introdução
Ligação química é qualquer interação que leve à associação de átomos em moléculas, íons, cristais e outras espécies estáveis que compõem as substâncias comuns do dia-a-dia. Quando os átomos aproximam-se uns dos outros, seus núcleos e elétrons interagem e tendem a se distribuir no espaço de tal modo que a energia total do sistema seja menor que qualquer outro arranjo possível. Se a energia total de um agrupamento for menor que a somatória das energias dos átomos isolados, eles então ligam-se e a diminuição de energia é chamada de energia de ligação.
As idéias que ajudaram a estabelecer a natureza da ligação química floresceram durante os primórdios do século XX, após a descoberta do elétron, e da mecânica quântica prover uma linguagem para descrever seu comportamento nos átomos. Entretanto, apesar dos químicos necessitarem da mecânica quântica para obter um entendimento quantitativo detalhado da formação das ligações, muito de seu entendimento pragmático é expresso por modelos simples e intuitivos. Estes modelos tratam as ligações como sendo de dois tipos - iônica ou covalente. O tipo de ligação que ocorre preferencialmente entre dois átomos pode ser previsto tomando-se como base a localização dos elementos na tabela periódica, e de algum modo também as propriedades das substâncias a serem formadas podem ser relacionadas ao tipo de ligação.
Um conceito-chave na discussão da ligação química é o de molécula. Moléculas são as menores unidades dos compostos que podem existir. Uma propriedade das moléculas que pode ser prevista com um grau razoável de sucesso é sua geometria. Geometrias moleculares são de considerável importância para o entendimento das reações que os compostos podem realizar e, assim, há um elo entre ligação e reatividade química.
A despeito dos modelos simples de ligação serem úteis como regras de racionalização da existência de compostos e de suas propriedades físicas e químicas, bem como das estruturas das moléculas, eles necessitam ser justificados apelando-se a descrições mais sofisticadas. Além disso, existem alguns aspectos sobre as estruturas moleculares que estão acima do escopo destas simples teorias. Para entender esta colocação, é necessário que se recorra a uma descrição plena da mecânica quântica. Tais aproximações numéricas fornecem informações importantes sobre as ligações químicas.
![]()
Histórico
A Emergência da Química Quantitativa
Os gregos antigos, mais notadamente Demócrito, argumentavam que a matéria era composta por partículas fundamentais chamadas átomos. As visões dos atomistas, entretanto, não possuíam suporte experimental, e nenhuma evidência da existência de átomos foi encontrada por dois milênios, até a emergência da ciência empírica no século XVIII.
A Lei da Conservação das Massas
A transformação crucial na química, partindo de uma coleção de esperanças vãs ou crenças alquímicas para um conhecimento quantitativo confiável, veio com as contribuições do aristocrata francês Antoine-Laurent Lavoisier (e sua esposa, Marie-Anne), pouco antes de perder sua cabeça à guilhotina no apogeu da Era das Trevas. Lavoisier abriu as portas para a química quantitativa estabelecendo que as transformações da matéria, que até então eram largamente reportadas através de um miasma de descrições desordenadas, podiam ser investigadas quantitativamente pela medida das massas das substâncias consumidas e produzidas nas reações químicas. A observação mais significativa por ele realizada foi a de que a massa total de produtos é a mesma que a dos reagentes. A implicação desta observação é que, apesar das identidades das substâncias se alterarem quando uma reação ocorre, ao menos uma propriedade mantém-se inalterada.
A Lei da Composição Constante
Os experimentos de Lavoisier inspiraram estudos posteriores que resultaram na reversão da visão de que a matéria era um contínuo desestruturado. Estas observações culminaram na teoria atômica desenvolvida pelo químico inglês John Dalton, que dita que a matéria é composta por partículas indestrutíveis que são únicas e características de cada elemento. Dois grupos principais de observações ajudaram a estabelecer este ponto de vista: primeiro, foi demonstrado que os compostos sempre possuem uma composição fixa, independentemente de sua origem. Assim, foi determinado que dezoito gramas de água consistem sempre de dois gramas de hidrogênio e dezesseis gramas de oxigênio, independentemente de como a amostra foi obtida. Estas observações sobrepuseram, ao menos temporariamente, as observações levantadas pelo químico francês Claude-Louis Berthollet de que os compostos tinham uma composição variável. As pesquisas atuais demonstram, entretanto, que de fato existem certas classes de compostos que apresentam composições vaiáveis. Entretanto, estas são uma minoria, e a Lei da Composição Constante é a regra, não a exceção.
A Lei das Proporções Múltiplas
O segundo passo através do raciocínio de Dalton foi o reconhecimento da existência de séries de compostos formados pelos mesmos elementos. Foi estabelecido, por exemplo, que, enquanto 28 gramas de monóxido de carbono invariavelmente consistem de 12 gramas de carbono e 16 gramas de oxigênio, o carbono também forma o composto dióxido de carbono, e 44 gramas deste composto sempre consistem de 12 gramas de carbono e 32 gramas de oxigênio. Neste exemplo, a massa do oxigênio que se combina com uma massa fixa de carbono para formar o dióxido de carbono é exatamente o dobro da quantidade que se combina para formar o monóxido de carbono. Tal observação sugere fortemente que o dióxido de carbono contém exatamente o dobro entidades de oxigênio por unidade de carbono que possui o monóxido de carbono.
Dalton previu que, quando dois elementos se combinam em uma série de compostos, as razões das massas de um elemento que se combina com uma massa fixa de um segundo são redutíveis a números inteiros menores; esta observação ficou conhecida como a Lei das Proporções Múltiplas.
A Teoria Atômica de Dalton
Dalton colocou todas estas observações juntas e então estabeleceu a linguagem que, com pequenas adaptações, tornou-se universal na química. Ele propôs que os elementos eram compostos por átomos indestrutíveis, que cada átomo de um elemento é idêntico, que os átomos de elementos diferentes diferem em temos de massa, e que os compostos consistem de um grupamento característico de átomos. Devido ao fato de um composto ser caracterizado por um grupamento de átomos e cada átomo possuir uma massa característica, foi então fácil entender que os compostos possuem uma composição em massa fixa. Além disso, a existência de famílias relacionadas de compostos, que diferem em massa por números inteiros, pode ser imediatamente explicada pela suposição de que vários compostos diferem no número de átomos de um elemento que se combina com um átomo de um segundo elemento. Por exemplo, o monóxido de carbono consiste de um átomo de carbono ligado a um átomo de oxigênio, enquanto que o dióxido de carbono consiste de um átomo de carbono ligado a dois átomos de oxigênio. Assim, em termos modernos, o monóxido de carbono é denotado como CO, e o dióxido de carbono como CO2.
![]()
Propriedades das Ligações Químicas
Valência
Os químicos do século XIX estabeleceram uma grande quantidade de informações empíricas que levaram à observação da existência de certos padrões nos tipos de compostos que os elementos podem formar. A mais útil característica que um elemento apresenta é sua valência, que foi originalmente definida em termos do número máximo de átomos de hidrogênio que podem se ligar a um átomo do elemento em questão. O hidrogênio foi selecionado como a sonda da valência dos compostos porque os observadores descobriram que um átomo de hidrogênio nunca era encontrado em combinação com mais de um outro átomo qualquer, e assim estabeleceram que este era o mais primitivo dos elementos. Desta maneira foi estabelecido que o oxigênio (O) possui normalmente a valência 2 (como na água, H2O), o nitrogênio uma valência 3 (como na amônia, NH3), e o cloro (Cl) a valência de 1 (como no ácido clorídrico, HCl). O exame destes padrões de ligação entre os elementos tornou possível a determinação das valências típicas para todos os elementos mesmo que fossem desconhecidos seus compostos com hidrogênio.
A despeito do conceito de valência ser altamente sugestivo como uma propriedade intrínseca dos átomos, havia alguns aspectos incoerentes, como a observação de alguns elementos aparentemente possuírem mais que uma valência comum. O elemento carbono, por exemplo, possui valências típicas de 2 e 4.
Compostos Iônicos e Covalentes
Uma segunda propriedade geral das ligações químicas também tornou-se evidente nos primórdios da química. Foi determinado que existiam duas classes majoritárias de compostos que podem ser distinguidos pelo seu comportamento quando dissolvidos em água. Uma classe é consistida pelos eletrólitos: compostos assim chamados porque suas soluções aquosas conduzem eletricidade. Os membros da outra classe, os não-eletrólitos, dissolvem-se para produzir soluções que não conduzem corrente elétrica. A diferença entre as duas classes deu origem à visão de que existiam dois tipos de ligações químicas. Os eletrólitos produziam íons em solução; um íon era então um átomo eletricamente carregado e transportava esta carga elétrica enquanto se movia pela solução. Os eletrólitos também eram constituídos por íons antes de serem dissolvidos para produzir íons em solução. Os não-eletrólitos não produziam íons quando dissolvidos e não eram constituídos por íons em seu estado agregado.
Tornou-se então evidente que alguns compostos eram formados por íons, enquanto que outros eram compostos por grupos de átomos que eram mantidos juntos de uma maneira diferente. Estes compostos foram chamados de covalentes. De fato, levou um bom tempo até a confirmação da existência dos íons antes mesmo de sua dissolução, e somente no início do século XX a evidência crucial foi obtida, mostrando a presença de entidades distintas, especificamente cátions sódio (átomos carregados positivamente), Na+, e ânions cloreto (átomos carregados negativamente), Cl-, em cloreto de sódio sólido (NaCl).
![]()
A Tabela Periódica
 Os padrões de valência
e tipo de ligação - iônica ou covalente - característicos dos elementos
foram elementos cruciais utilizados como evidência pelo químico russo Dmitry
Ivanovich Mendeleyev para compilar a tabela periódica, onde os elementos
químicos são organizados em famílias de acordo com suas similaridades. Assim,
o oxigênio e o enxofre (S), que possuíam a valência de 2-, foram colocados
dentro da mesma família, e o nitrogênio e o fósforo (P), com a valência
típica de 3-, foram alocados em uma família vizinha. A tabela periódica
mostrou-se o único conceito unificador universal em química devido ao fato de
sintetizar uma grande quantidade de informações de maneira visualmente
esquemática. Os elementos metálicos situavam-se à esquerda na tabela e
normalmente formavam compostos iônicos. Os elementos não-metálicos, que formavam
um grande número de compostos covalentes quando combinavam-se entre si, foram
alocados à direita da tabela. Se por um momento os casos especiais dos
elementos das colunas 3 a 12 na tabela, chamados de elementos de transição,
fossem ignorados, então as valências típicas dos elementos iniciar-se-iam em
1+ no extremo esquerdo, aumentando de uma em uma unidade no deslocamento à
direita, atingindo 4+ na família encabeçada pelo carbono (C) e então cairiam
de uma em uma unidade até atingir 1- na família que contém o flúor. Aqui,
pelo menos, estava um comportamento de valência que qualquer explanação sobre
a formação de ligações químicas necessita justificar.
Os padrões de valência
e tipo de ligação - iônica ou covalente - característicos dos elementos
foram elementos cruciais utilizados como evidência pelo químico russo Dmitry
Ivanovich Mendeleyev para compilar a tabela periódica, onde os elementos
químicos são organizados em famílias de acordo com suas similaridades. Assim,
o oxigênio e o enxofre (S), que possuíam a valência de 2-, foram colocados
dentro da mesma família, e o nitrogênio e o fósforo (P), com a valência
típica de 3-, foram alocados em uma família vizinha. A tabela periódica
mostrou-se o único conceito unificador universal em química devido ao fato de
sintetizar uma grande quantidade de informações de maneira visualmente
esquemática. Os elementos metálicos situavam-se à esquerda na tabela e
normalmente formavam compostos iônicos. Os elementos não-metálicos, que formavam
um grande número de compostos covalentes quando combinavam-se entre si, foram
alocados à direita da tabela. Se por um momento os casos especiais dos
elementos das colunas 3 a 12 na tabela, chamados de elementos de transição,
fossem ignorados, então as valências típicas dos elementos iniciar-se-iam em
1+ no extremo esquerdo, aumentando de uma em uma unidade no deslocamento à
direita, atingindo 4+ na família encabeçada pelo carbono (C) e então cairiam
de uma em uma unidade até atingir 1- na família que contém o flúor. Aqui,
pelo menos, estava um comportamento de valência que qualquer explanação sobre
a formação de ligações químicas necessita justificar.
Fato desconhecido por Mendeleyev, e não descoberto até o final do século XIX e início do século XX, foi outra família de elementos que foram originalmente atribuídos como inertes e então chamados de gases inertes. Esta família é encabeçada pelo hélio (He) e inclui o neônio (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn). Durante os anos sessenta a inatividade química desses compostos foi derrubada, e alguns membros dessa família (essencialmente apenas o criptônio e o xenônio) formaram compostos induzidos. Assim, o nome gases inertes foi substituído pelo termo gases nobres, que refletia sua estabilidade química mas não a inércia total. Esta família de elementos foi inicialmente tomada como irrelevante para o entendimento das ligações químicas. Entretanto, o fato de estes elementos realmente não formarem qualquer tipo de ligação provou-se crucial para o desenvolvimento das teorias modernas da formação de ligações.
![]()
Evidências Adicionais da Existência dos Átomos
A Lei de Avogadro
Até o início do século XX alguns céticos denotavam a teoria atômica como não mais que uma hipótese não-substancial ou um dispositivo conveniente para algumas situações. A realidade da existência dos átomos e das moléculas por eles formadas era largamente evocada mas não universalmente aceita; entretanto a oposição à realidade atômica diminuía enquanto as evidências experimentais aumentavam. Entre as evidências historicamente significantes está a medição quantitativa dos volumes dos gases. Também foi notado que, quando a água era decomposta por eletrólise (isto é, pela passagem de corrente elétrica), os gases oxigênio e hidrogênio eram produzidos na proporção de 2:1 em volume. Esta observação levou o cientista italiano Amadeo Avogadro a propor que volumes iguais de gases (a uma mesma temperatura e pressão) contém números iguais de moléculas. A eletrólise da água mostrou-se então consistente com uma molécula de água formada por dois átomos de hidrogênio e um de oxigênio, e assim consistente também com a fórmula química H2O. Hoje é sabido que o gás hidrogênio consiste de moléculas de H2 e o gás oxigênio é consistido por moléculas de O2, mas à época este importante detalhe não desfigurou a interpretação física.
A Teoria Cinética dos Gases
Os volumes medidos dos gases sustentaram a existência dos átomos e moléculas. A emergência da ciência mecânica aperfeiçoou seu entendimento, enquanto as propriedades dos gases foram preditas baseadas na hipótese de que eram compostos de partículas diminutas em movimento incessante e caótico. Deste modelo cinético dos gases foi possível calcular a pressão exercida por um gás e a velocidade média das moléculas, e foram obtidas excelentes concordâncias com os fenômenos observados.
Imagens Visuais dos Átomos
A oposição remanescente à existência dos átomos foi ao chão no início do século XX quando técnicas foram desenvolvidas para mostrar representações visuais dos átomos. As primeiras técnicas fizeram uso da difração de raios X, onde o padrão de interferência entre os raios que eram refletidos por um cristal podiam ser interpretados em termos da distorção provinda de seus átomos individuais. Mais imagens de átomos foram produzidas nos anos sessenta pela utilização de métodos que retiravam elétrons dos arranjos atômicos nas superfícies dos sólidos de tal modo que mapas dessas superfícies podiam ser construídos, e a evolução de técnicas de microscopia eletrônica aumentaram o poder de resolução do microscópio a um ponto próximo da distinção de átomos individuais. A mais recente e visualmente completa evidência veio nos anos oitenta com o desenvolvimento da microscopia de tunelamento eletrônico. Nesta técnica, uma agulha aponta para uma posição suficientemente estreita de modo a promover a movimentação de um único átomo, como uma sonda delicada sobre a superfície da amostra, e sua posição é monitorada. Os resultados aparecem na forma de uma imagem da superfície da amostra. Esta técnica foi considerada perfeita pelo ponto de vista em que pode ser utilizada para determinar a localização dos átomos individualmente. Destas técnicas, a microscopia eletrônica foi a que mais se aproximou da visão atual de um átomo, pois a imagem requer pouca manipulação. Imagens obtidas pela difração de raios X requerem extensiva manipulação matemática. Tanto a emissão de raios como a microscopia por varredura de superfície fornecem imagens das propriedades de uma superfície em uma escala atômica, bem como suas propriedades.
![]()
Estrutura Molecular
Muitos químicos estavam convencidos de que os átomos existiam mesmo antes do desenvolvimento destas técnicas sofisticadas fornecerem evidências irrefutáveis. No século XIX, quando as composições de incontáveis compostos estavam sendo determinadas, foi encontrado que em certos casos compostos diferentes possuíam a mesma composição química. Assim, a composição C3H4 foi encontrada para dois compostos orgânicos inteiramente diferentes (como determinado por suas propriedades físicas e químicas) - o propino e o propadieno. Resolutos em suas análises, os químicos foram forçados a concluir que os dois compostos diferem na maneira como seus átomos se ligam. Assim, a noção de estrutura molecular (isto é, o arranjo dos átomos no espaço) adentrou na química e, por conseqüência, suportou a visão de que os átomos eram reais. Em termos modernos, estes compostos são representados por:
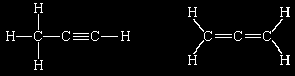
Quase que ao mesmo tempo (em 1860), um aspecto mais sutil da estrutura atômica tornou-se aparente - o da disposição espacial tridimensional dos átomos nas moléculas. O conceito da estrutura molecular iniciou-se com a evidência de que os átomos possuiam diferentes ligantes em diferentes posições a despeito de suas composições químicas serem as mesmas (como nas duas estruturas correspondentes à fórmula C3H4). Esta é uma distinção topológica, isto é, baseada em qual átomo é ligado em qual outro átomo. A distinção adicional introduzida é geométrica, referindo-se à disposição espacial dos átomos. Como um exemplo deste tipo de distinção, o composto diclorometano (CH2Cl2) pode ser considerado. A estrutura topológica da molécula é:
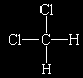
com os átomos de hidrogênio e cloro ligados a um átomo central de carbono. Foi observado que existe apenas um composto como este. O resultado desta observação foi que a molécula não poderia ser planar porque, se este fosse o caso, seriam encontradas duas moléculas diferentes com a fórmula CH2Cl2:
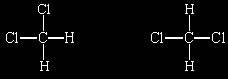
O fato de existir apenas um diclorometano sugeria que suas moléculas eram tetraédricas, porque qualquer que fosse o arranjo dos quatro átomos de cloro e hidrogênio ligados ao átomo central de carbono, a molécula seria idêntica (desconsiderando-se sua orientação no espaço, que era irrelevante):
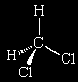
Com observações como estas, a noção de geometria molecular assimilou-se à química e desde então assumiu uma posição central e fundamental no estudo de propriedades e atividades dos compostos.
Os químicos do século XIX tinham que inferir as geometrias moleculares por experimentação indireta. O entendimento moderno da geometria molecular é mais direta (se descontada a intervenção computacional que existe entre a observação e a representação). Em particular, a difração de raios X forneceu imagens incomparavelmente detalhadas de moléculas, mesmo tão grandes quanto as de proteínas, que contém centenas de átomos. A microscopia de tunelamento eletrônico, apesar de ser muito mais recente, promoveu imagens muito mais realistas que confirmaram acima de qualquer dúvida as propriedades da geometria molecular.
A importância da determinação (e entendimento) da estrutura molecular não pode ser superestimada. Ao nível mais simples, as propriedades das moléculas pequenas (incluindo a típica e importante molécula de água) são devidas em grande parte à suas geometrias e não meramente à suas composições atômicas. Os oceanos, por exemplo, talvez não existiriam se as moléculas de água fossem lineares e não angulares, pois assim as interações entre as moléculas não seriam tão fortes e seria improvável que água líquida, e por conseqüência a vida na Terra, existissem. Ao nível mais complexo, o das proteínas, a estrutura geométrica era essencial a sua função bioquímica tinha papel fundamental em todos os organismos vivos.
![]()
A Estrutura Interna dos Átomos
O conceito dos átomos assim emergiu, das medições meticulosas de massa e volume, e nos primórdios da química constituíam as únicas ferramentas quantitativas da matéria disponíveis. A realidade dos átomos foi estabelecida, por um lado, pelo poder exploratório do modelo cinético, e por outro lado pelas imagens cada vez mais diretas de entidades microscópicas. Enquanto o modelo atômico da matéria se tornava mais firmemente estabelecido, a atenção se voltou para a existência das moléculas, que eram arranjos específicos dos átomos. Enquanto as moléculas eram examinadas, foi descoberto que elas apresentavam ligações características entre os átomos e que estes eram posicionados em arranjos tridimensionais característicos dos compostos e de seus átomos constituintes.
A Descoberta do Elétron
As questões levantadas por este conhecimento básico permaneceram sem respostas até que a estrutura interna dos átomos começou a ser revelada no final do século XIX. A visão clássica, proposta por Dalton, de que os átomos eram compostos por entidades irredutíveis e desprovidas de carga virtualmente eliminava o prospecto de entendimento de suas propriedades, pois implicava na inexistência de sua estrutura interna. A mutabilidade dos átomos, e assim os primeiros sinais de entendimento de sua constituição e propriedades, surgiram com a descoberta do elétron como um constituinte universal da matéria. O elétron foi a primeira partícula subatômica a ser descoberta e demonstrou ser a mais importante para o entendimento das ligações químicas. Esta importância deveu-se em grande parte à facilidade com que os elétrons podiam ser removidos de um átomo e inseridos em outro; esta facilidade de transferência de elétrons foi a chave da formação das ligações químicas, e todas as teorias nesse campo focavam-se na redistribuição dos elétrons de um átomo quando se ligava com outro.
A idéia central para o entendimento da estrutura da tabela periódica e também dos padrões de ligação química entre átomos foi a de que os elétrons distribuíam-se em camadas que rodeavam um núcleo central positivamente carregado. Cada camada podia conter um número máximo característico de elétrons. As camadas mais externas continham os elétrons envolvidos na formação das ligações, pois estes eam menos atraídos pelo núcleo e assim podiam ser removidos com maior facilidade. Esta camada era chamada de camadal de valência. Uma das características mais importantes das camadas de valência era o fato desta ser completa para os gases nobres (isto é, oito, exceto no caso do hélio). Assim, a formação de ligações químicas parecia estar relacionada com a complementação da camada de valência.
Contribuições de Lewis
A regra da camada de valência na formação das ligações foi exposta pelo químico americano Gilbert N. Lewis no ano de 1916. Estudos independentes importantes foram conduzidos por Walther Rossel, e mais tarde contribuições foram adicionadas por Irving Langmuir. Primeiramente, Lewis propôs que as ligações iônicas eram formadas pela transferência completa de elétrons da camada de valência de um átomo para a camada de valência de outro, e que esta transferência continuava até que ambos os átomos atingissem a configuração eletrônica característica do gás nobre mais próximo na tabela periódica. Assim, o sódio possuía um elétron na sua camada de valência, e sua perda resultava em um cátion, Na+, com um arranjo de elétrons como o do neônio. O cloro, por outro lado, possuía uma camada de valência que necessitava de um elétron a mais para atingir a configuração eletrônica característica do gás nobre vizinho, o argônio, e assim formava o ânion Cl-. Assim, a formação de cloreto de sódio como um coleção de íons Na+ e Cl- tornava-se perfeitamente compreensível.
Lewis propôs que a ligação covalente consistia no compartilhamento de dois elétrons entre átomos, ao invés de sua doação plena de um átomo para o outro. Ele não tinha meios de saber por que um par de elétrons deveria ser tão importante (este entendimento veio algum tempo depois, com a introdução da mecânica quântica), mas suas idéias racionalizavam um grande número de fatos químicos. Como na formação de ligações iônicas, Lewis enfatizava a importância da camada de valência do gás nobre mais próximo e propunha que, como na formação das ligações iônicas, o compartilhamento desses elétrons continuaria até que cada átomo possuísse a configuração eletrônica de um gás nobre.
Em resumo, as idéias de Lewis eram expressas por sua recente regra do octeto, que atestava que a transferência ou compartilhamento de elétrons continuaria até que um átomo adquirisse um octeto de elétrons (isto é, os oito elétrons característicos da camada de valência de um gás nobre). Quando a transferência completa ocorresse, a ligação seria iônica. Quando os elétrons fossem meramente compartilhados, a ligação seria covalente, e cada par de elétrons compartilhados corresponderia a uma ligação química.
Esta teoria constitui a base da ligação química que continua sendo largamente utilizada. Entretanto, ainda existe muito mais a explicar e entender; e existem muitas exceções importantes às idéias de Lewis, que não podem, por conseqüência, prover uma explicação completa das ligações químicas.