As alterações químicas que ocorrem quando a luz atinge a retina do
olho envolvem muitos fenômenos da química orgânica e da fotoquímica, área
de estudo da físico-química. O ponto central para o entendimento do processo
visual em escala molecular são dois fenômenos em particular: a absorção da
luz pelos polienos conjugados (moléculas orgânicas com várias duplas ligações
em série) e a interconversão de isômeros cis-trans.
A retina do olho humano contém dois tipos de células receptoras.
Devido a seus formatos, estas células recebem o nome de bastonetes e cones.
Os bastonetes estão localizados primordialmente na periferia da retina e são
responsáveis pela visão com luminosidade reduzida. Estas células, entretanto, são
"cegas" às cores e, portanto, vêem
apenas as tonalidades de cinza. Os cones são encontrados principalmente no
centro da retina e são responsáveis pela visão com luminosidade considerável.
Também possuem os pigmentos que são responsáveis pela visão das
cores.
Alguns animais não possuem cones ou bastonetes. As retinas dos pombos
contém apenas cones. Assim, apesar de conseguirem distinguir as cores, estas
aves enxergam apenas na brilhante luz do dia. As retinas das corujas, por
outro lado, possuem apenas bastonetes; as corujas enxergam muito bem sob
luminosidade reduzida mas são cegas às cores.
As alterações químicas que ocorrem nos bastonetes são muito melhor entendidas que aquelas que ocorrem nos cones. Por este motivo, vamos nos concentrar apenas no estudo da visão promovida pelos bastonetes.
Quando a luz atinge as células bastonetes, é absorvida por um
composto denominado rodopsina. Esta substância, por sua vez,
inicia uma série de eventos químicos que por fim resultam na transmissão de
um impulso nervoso ao cérebro.
Nosso entendimento da natureza química da rodopsina e das mudanças
conformacionais que ocorrem quando esta substância absorve luz é resultado em
grande parte pelas pesquisas de George Wald e colaboradores, na Universidade de
Harvard. As pesquisas de Wald iniciaram-se em 1933, quando era um estudante
de graduação em Berlin; o estudo da rodopsina, entretanto, iniciou-se muito
antes em outros laboratórios.
A rodopsina foi descoberta em 1877 pelo fisiologista alemão Franz Boll. Boll notou que a coloração vermelho-púrpura, inicialmente presente na retina de sapos, desapareceu pela ação da luz. O processo de supressão da cor levou primeiramente a uma retina amarelada e, posteriormente, a uma incolor. Um ano depois, outro cientista alemão, Willy Kuhne, isolou o pigmento vermelho-púrpura e o nomeou, devido à sua coloração, de Sehpurpur, ou "púrpura visível". O nome "púrpura visível" continua sendo comumente utilizado para rodopsina.
Em 1952, Wald e uma de suas estudantes, Ruth Habard, mostraram que o
cromóforo (um grupo orgânico que absorve luz) da rodopsina é um aldeído
poli-insaturado, o 11-cis-retinal. A rodopsina é o produto da reação
deste aldeído com uma proteína chamada opsina. A reação ocorre entre
o grupo aldeído do 11-cis-retinal e um grupo amina na cadeia da proteína
e envolve a perda de uma molécula de água. Outras interações secundárias
envolvendo grupos -SH da proteína provavelmente também mantém o cis-retinal
no lugar. A vacância na cadeia da proteína é onde o cis-retinal
encaixa-se precisamente.
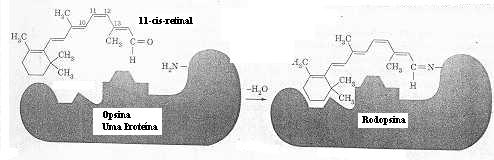
Formação
da rodopsina a partir do 11-cis-retinal e opsina
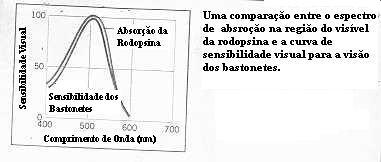
A cadeia polinsaturada conjugada do 11-cis-retinal fornece à
rodopsina a habilidade de absorver luz em uma região muito larga do espectro
visível. A figura abaixo mostra a curva de absorção da rodopsina na região
do visível e a compara com a curva de sensibilidade para a visão dos bastões
do olho humano. O fato destas duas curvas coincidirem fornece forte evidência
de que a rodopsina é o composto fotossensível na visão por bastonetes.
Quando a rodopsina absorve um fóton de luz, o cromóforo do 11-cis-retinal sofre isomerização para a forma all-trans. O primeiro fotoproduto é um intermediário chamado batorodopsina, um composto que possui cerca de 150kJ.mol-1 de energia a mais que a rodopsina. A batorodopsina, passando por uma série etapas, transforma-se na metarodopsina II (também all-trans). A alta energia da combinação proteína-cromóforo all-trans provoca uma alteração em sua geometria. Como resultado, uma miríade de reações enzimáticas culmina na transmissão de um impulso neural ao cérebro. O cromóforo é finalmente hidrolisado e expelido como all-trans retinal.

As
etapas importantes no processo visual. Absorção de um fóton de luz pelo
fragmento 11-cis-retinal da rodopsina gera um impulso nervoso como
resultado de uma isomerização que leva, através de uma série de passos, à
metarodopsina II. Então, a hidrólise da metarodopsina II produz all-trans-retinal
e rodopsina. Esta gravura simplifica extremamente a estrutura da rodopsina; a
porção retinal está na verdade envolvida por uma complexa estrutura protéica.
A rodopsina possui absorção máxima em 498nm, que fornece a coloração vermelho-púrpura. Juntos, o all-trans retinal e a opsina possuem absorbância máxima em 387nm e, por isso, o aduto possui coloração amarela. A transformação iniciada pela luz da rodopsina ao all-trans retinal corresponde à supressão inicial observada por Boll nas retinas dos sapos. A supressão subseqüente ao composto incolor ocorre quando o all-trans retinal é enzimaticamente reduzido ao all-trans vitamina A. Esta redução converte o grupo aldeído do retinal ao álcool primário correspondente da vitamina A.
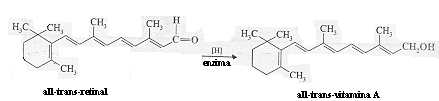
Representação estrutural do retinal e do ácido retinóico,
ou vitamina A, essencial para a visão - a falta desta vitamina do organismo
provoca anomalias na visão, e deve ser suprida com complexos vitamínicos
sintéticos.
Outro aspecto interessante da química da visão é sua cinética. Quando você abre os olhos, quanto tempo "aguarda" até começar a enxergar? Praticamente nada! Essas reações, com grau razoável de complexidade, ocorrem na retina do olho na ordem de fentosegundos, ou 10-15 segundos. O corpo humano é ou não a "máquina" perfeita?
Adaptado por A. Krell