A indústria de produtos de higiene e limpeza movimenta cifras consideráveis, não só no Brasil como no mundo. A necessidade de assepsia e asseio pessoal já foi a principal força motriz desta indústria. Hoje, os efeitos cosméticos destes produtos competem pelo centro das atenções.
Neste artigo, veremos como os sabões e detergentes são sintetizados, como removem a sujeira, principalmente a gordura, e o conceito de detergentes biodegradáveis.
![]()
A manufatura do sabão constitui uma das sínteses químicas mais antigas; menos antiga, entretanto, que a produção do álcool etílico utilizado nas bebidas - os anseios de limpeza do homem são, na verdade, muito mais recentes que seus desejos de estímulo alcoólico. Ao ferverem o sebo de cabra com a lexívia potássica feita com as cinzas de madeira, as tribos germânicas, contemporâneas de César, realizaram a mesma reação química que o processo moderno de fabricação de sabão: a hidrólise de glicerídios. A reação dá origem aos sais de ácidos carboxílicos e ao glicerol:
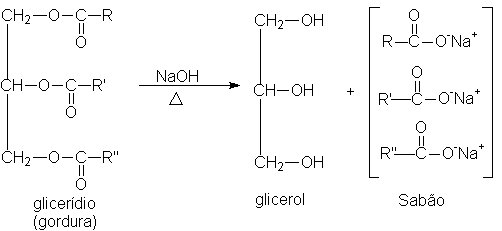
O sabão comum que utilizamos atualmente é simplesmente uma mistura de sais de sódio ou potássio de ácidos graxos de cadeia longa. É uma mistura porque a gordura a partir da qual é preparado é constituída de uma mistura de ácidos graxos, mas que é tão eficiente para lavagem quanto um sal puro.
As características do sabão podem variar de acordo com a composição e segundo o método de fabricação: se preparado a partir do azeite de oliva, recebe o nome de sabão de Marselha; pode-se adicionar álcool durante o processo de fabricação para torná-lo transparente; por agitação, pode-se incorporar ar, fornecendo-lhe a propriedade de flutuar; podem-se adicionar perfumes, corantes e germicidas; se for utilizado o hidróxido de potássio na síntese (ao invés do de sódio), tem-se o sabão mole. Entretanto, quimicamente o sabão permanece exatamente o mesmo, atuando do mesmo modo.
À primeira vista, pode-se ter a impressão de que estes sais são solúveis em água; de fato, podem-se preparar as chamadas "soluções da sabão". Elas não são, entretanto, verdadeiras soluções, onde as moléculas do soluto movem-se livremente entre as moléculas do solvente. Verifica-se, na realidade, que o sabão se dispersa em agregados esféricos denominados micelas, cada uma das quais pode conter centenas de moléculas de sabão.
Uma molécula de sabão tem uma extremidade polar, -COO-Na+, e uma parte não polar, constituída por uma longa cadeia alquílica, normalmente com 12 a 18 carbonos. A extremidade polar é solúvel em água (hidrófila - que tem afinidade por água). A parte apolar é insolúvel em água, e denomina-se hidrófoba (ou lipófila - que tem aversão por água e afinidade por óleos e gorduras), mas é evidentemente solúvel em solventes apolares. Moléculas que têm extremidades polares e apolares e, além disso, são suficientemente grandes para que cada extremidade apresente um comportamento próprio relativo à solubilidade em diversos solventes denominam-se anfipáticas.
De acordo com a regra "polar dissolve polar; apolar dissolve apolar", cada extremidade apolar procura um ambiente apolar. Em meio aquoso, o único ambiente deste tipo existente são as partes apolares das outras moléculas do sabão, e assim elas se agregam umas às outras no interior da micela. As extremidades polares projetam-se da periferia dos agregados para o interior do solvente polar, a água. Os grupos carboxilatos carregados negativamente alinham-se à superfície das micelas, rodeados por uma atmosfera iônica constituída pelos cátions do sal. As micelas mantém-se dispersas devido à repulsão entre as cargas de mesmo sinal das respectivas superfícies.
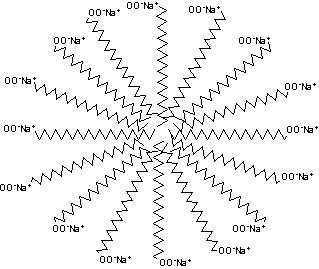
Uma micela pode conter centenas de moléculas de sais de ácidos graxos
Ainda resta, entretanto, uma questão cabal a responder: como o sabão remove a gordura, sendo feito dela? O problema na lavagem pelo sabão está na gordura e óleo que constitui ou que existe na sujeira. Apenas a água não é capaz de de dissolver as gorduras, por serem hidrofóbicas; as gotas de óleo, por exemplo, em contato com a água, tendem a coalescer (aglutinar-se umas às outras), formando uma camada aquosa e outra oleosa. A presença do sabão, entretanto, altera este sistema. As partes apolares das moléculas do sabão dissolvem-se nas gotículas do óleo, ficando as extremidades de carboxilatos imersas na fase aquosa circundante. A repulsão entre as cargas do mesmo sinal impede as gotículas de óleo de coalescerem. Forma-se, então, uma emulsão estável de óleo em água que é facilmente removida da superfície que se pretende limpar (por agitação, ação mecânica, etc.). Deste modo, sabões atuam, no processo de limpeza, como surfactantes - compostos com ação ativa em superfícies ou interfaces de substâncias.
A chamada água dura contém sais de cálcio e magnésio que reagem com o sabão formando carboxilatos de cálcio e magnésio insolúveis. Você nota que a água de uma determinada região é dura quando forma-se uma crosta nas bordas do recipiente que continha o sabão ou quando, ao tomar banho ou lavar as mãos, sente que uma fina película permanece sobre sua pele. Águas subterrâneas são, via de regra, ricas em cálcio e magnésio e, portanto, duras.
![]()
À partir dos ácidos graxos das gorduras também é possível, à partir de vias sintéticas características, obterem-se álcoois primários. Entre os álcoois primários de cadeia linear que se obtém das gorduras - ou de outros modos - os de C8 e C10 são utilizados na produção de ésteres de alto ponto de ebulição, usados como plastificantes (como por exemplo, o ftalato de octila). Os álcoois de C12 a C18 são utilizados em quantidades enormes na manufatura de detergentes (produtos tensoativos para limpeza).
Embora os detergentes sintéticos difiram significativamente uns dos outros quanto a estrutura química, as moléculas de todos têm uma característica em comum, também apresentada pelas de sabão comum: são anfipáticas, com uma parte apolar muito grande, de natureza de hidrocarboneto, solúvel em óleo, e uma extremidade polar, solúvel em água. Um tipo deles resulta da conversão dos álcoois de C12 a C18 em sais de hidrogenosulfato de alquila. Por exemplo:

Neste sal, a parte apolar é a longa cadeia alquílica e a parte polar é a ponta -SOO3-Na+.
Diferentemente dos sabões, os detergentes podem ser não-iônicos. Pelo tratamento dos álcoois com óxido de etileno, obtém-se um deles:
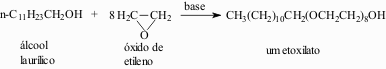
A possibilidade de formação de pontes de hidrogênio entre as moléculas da água e os numerosos átomos de oxigênio do etoxilato tornam a parte terminal de poliéter solúvel em água. Os etoxilatos também podem ser convertidos em sulfatos, sendo utilizados na forma de sais de sódio.
Os sais de sódio dos ácidos alquilbenzeno-sulfônicos são os detergentes mais utilizados. Para obtenção destes detergentes, liga-se primeiramente o grupo alquil de cadeia longa a um anel benzênico pela utilização de um haleto de alquila, de um alceno ou de um álcool conjuntamente com um catalisador de Friedel-Crafts (AlCl3); em seguida, efetua-se a sulfonação e, finalmente, a neutralização:
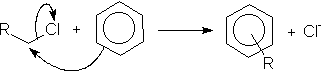
reação de alquilação por adição nucleofílica aromática em haleto de
alquila
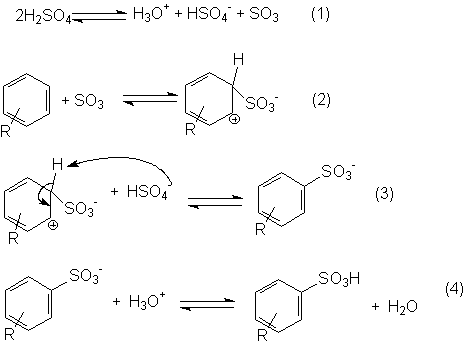
Mecanismo da reação de sulfonação
O primeiro passo, em que se forma o trióxido de enxofre (SO3), eletrofílico, é simplesmente um equilíbrio ácido-base entre duas moléculas de ácido sulfúrico. Na sulfonação utiliza-se geralmente o ácido sulfúrico fumegante, ou seja, aquele onde é dissolvido excesso de SO3; mesmo quando utiliza-se apenas ácido sulfúrico, crê-se que o SO3 formado no passo (1) possa ser o eletrófilo.
No passo (2) o reagente eletrofílico, SO3, liga-se ao anel benzênico com formação de um carbocátion intermediário. Embora o trióxido de enxofre não tenha cargas positivas, tem deficiência de elétrons (carga parcial positiva) sobre o átomo de enxofre, pois os três átomos de oxigênio, mais eletronegativos, retiram-lhe elétrons por indução.
Na terceira etapa o carbocátion cede um próton para o ânion HSO4- e forma o produto de substituição estabilizado por ressonância que é, desta vez, um ânion - o do ácido benzeno-sulfônico; este ácido, por ser forte, encontra-se altamente ionizado (na etapa 4, o equilíbrio está muito deslocado para a esquerda).
Com alguns substratos aromáticos e certos acidulantes, o eletrófilo pode ser HSO3+ ou moléculas que possam facilmente transferir SO3 ou HSO3+ para o anel aromático.
A conclusão da síntese do detergente dá-se pela neutralização do ácido benzenosulfônico, formando o sal hidrosolúvel.
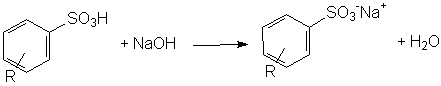
Neutralização do ácido benzenosulfônico.
Até há algum tempo atrás, utilizava-se vulgarmente o propileno para a síntese destes alquilbenzeno-sulfonatos. A cadeia lateral altamente ramificada impedia a degradação biológica do detergente. Na maioria dos países industrializados, estes detergentes vêm sendo substituídos por outros biodegradáveis desde 1965. São sulfatos de alquila, etoxilatos e respectivos sulfatos, e alquilbenzenosulfonatos em que o grupo fenila fixa-se ao acaso a qualquer das diversas posições secundárias da longa cadeia alifática linear (C12-C18). As cadeias laterais destes alquilbenzeno-sulfonatos lineares obtém-se de 1-alcenos de cadeia linear ou de alcanos de cadeia contínua clorados, separados do ceroseno por formação de clatratos (peneiras moleculares).
Estes detergentes atuam essencialmente da mesma maneira que o sabão. A sua utilização oferece, entretanto, certas vantagens. Por exemplo, os sulfatos e sulfonatos mantém-se eficazes em água dura devido ao fato de os correspondentes sais de cálcio e magnésio serem solúveis. Visto serem sais de ácidos fortes, produzem soluções neutras, ao contrário dos sabões que, por serem sais de ácidos fracos, originam soluções levemente alcalinas.