Polímeros sintéticos têm diversas aplicações em vários setores da sociedade moderna, sejam elas industriais, medicinais, biológicos, etc. São substâncias relativamente fáceis de serem sintetizadas em escala laboratorial. Existem vários processos de polimerização, como os via radicalar e por reações de policondensação.
Para obterem-se materiais poliméricos orgânicos e inorgânicos com as mais variadas propriedades físicas podem-se utilizar os mais diversos recursos químicos e físicos antes, durante e/ou depois da reação de polimerização.
![]()
Polímeros
são grandes moléculas geralmente constituídas de muitas unidades menores
denominadas monômeros. O grau de polimerização refere-se ao número médio
de unidades monoméricas por molécula do polímero.
Existem polímeros naturais, como as proteínas, os polissacarídeos e os polipeptídios, e polímeros sintéticos, como o poliestireno e o polidimetilsiloxano. Os polímeros sintéticos tornaram-se componentes importantes na sociedade moderna como materiais vitais em vários segmentos industriais.
Os polímeros sintéticos podem ser categorizados de acordo com o tipo de reação de polimerização utilizada. Polímeros de adição envolvem a conversão de múltiplas ligações nos monômeros em ligações entre as unidades monoméricas. Exemplos importantes são a polimerização dos alcenos e dienos e podem envolver carbocátions, radicais livres, carbânions e organometálicos como intermediários. Polímeros de adição resultam da reação de unidades monoméricas, usualmente acompanhada pela perda de uma pequena molécula neutra como água, álcool ou CO2. Exemplos são os poliésters e poliamidas derivados da reação de ácidos dicarboxílicos ou ésteres com dióis e diaminas, respectivamente.
O poliestireno (PS) é um dos polímeros mais conhecidos nos dias de hoje. Utilizado em uma grande variedade de embalagens e outros instrumentos, é comumente conhecido por sua excelente rigidez, brilho e solubilidade relativamente baixa na maioria dos solventes, principalmente quando utilizadas substâncias capazes de fazer estruturas com ramificações cruzadas.
A alta rigidez do poliestireno está associada a sua elevada cristalinidade. Materiais mais cristalinos geralmente possuem maior rigidez, implicando em propriedades mecânicas pobres para o material. Por exemplo, materiais muito cristalinos são pouco flexíveis e mais quebradiços.
Poliestireno é formado por reações de adição radicalar no grupo vinila, promovida por um iniciador, geralmente um peróxido. Os peróxidos sofrem clivagem homolítica nas ligações O-O quando submetidos a temperaturas elevadas e fornecem duas moléculas radicalarmente ativadas. Na produção do poliestireno, o peróxido comumente utilizado é o de benzoíla:
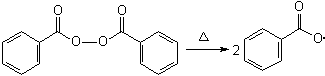
Figura 1 - Clivagem homolítica do peróxido de benzoíla, formando dois radicais derivados de ácido benzóico.
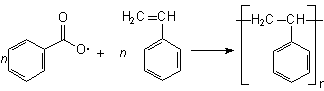
Figura 2 - Formação do poliestireno pela reação de radicais derivados de ácido benzóico com o estireno.
No processo industrial de síntese do poliestireno é comum utilizar-se 1,4–divinilbenzeno. Este componente é adicionado para modificar a solubilidade do material. O divinilbenzeno pode criar ramificações nas cadeias principais do polímero promovendo a formação de cadeias secundárias, devido a sua bifuncionalidade, e o polímero deixa de ser linear. Quando isto acontece, diz-se que o polímero está reticulado.
Um polímero reticulado forma uma estrutura tridimensional que pode torná-lo menos solúvel a solventes apolares. O poliestireno é um polímero fracamente polar, praticamente apolar, e por isso é muito solúvel em solventes orgânicos apolares ou pouco polares. Para diminuir este efeito de solubilidade pode-se reticular o polímero com 1,4–divinilbenzeno e obter um material menos solúvel, que na presença destes solventes apenas intumesce.
A
síntese de polímeros realizadas por via radicalar pode produzir muito calor,
pois estas reações geralmente apresentam uma alta entalpia de reação. Assim
costumam-se utilizar reatores selados ou atmosferas inertes para sínteses
desses materiais em grande escala, pois a energia liberada pela reação pode
causar explosões. Alguns polímeros sintetizados radicalarmente produzem tanto
calor que precisam ser resfriados durante o processo, pois esse calor inicia a
degradação do produto final da reação
Polímeros de silicone também são largamente conhecidos e estão consideravelmente difundidos nos mais variados segmentos da sociedade moderna. São utilizados como fluídos especiais, elastômeros ou borrachas, selantes, adesivos e impermeabilizantes. A produção de polímeros de silicone chega a aproximadamente 200.000 toneladas/ano.
Um dos polímeros de silicone mais comuns é o polidimetilsiloxano, que pode ser sintetizado pela hidrólise do monômero dimetilclorosilano; a polimerização é catalisada pelo próprio ácido clorídrico gerado no meio:
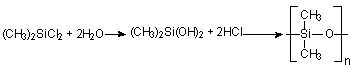
Figura
3 - Síntese do polidimetilsiloxano a partir do cloreto de dimetilsilano (diclorodimetilsilano).
A reação pode ser acelerada pela adição de pequenas quantidades de ácido. Os ácidos catalisadores preferidos são aqueles que podem ser facilmente removidos pela lavagem do sistema com água, como HCl, HCOOH, (COOH)2, Cl3CCOOH e CH2COOH.
A catálise
do (CH3)2Si(OH)2 dá-se de acordo com o
seguinte mecanismo:
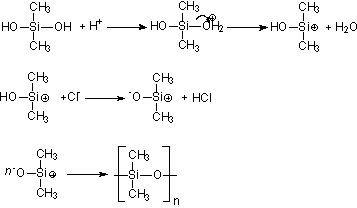
Figura 4 - Mecanismo de formação do polidimetilsiloxano
O polímero
pode ser reticulado com ácido bórico para formar a borracha de silicone: um
polímero com aspecto de goma, que apresenta alta conversão do momento linear
sob impacto e propriedades viscoelásticas acentuadas:
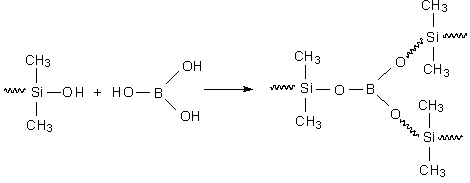
Figura
5 - Reticulação do poli(dimetilsiloxano) com ácido bórico.
Diferentemente da síntese radicalar do poliestireno, a síntese do poli(dimetilsiloxano) ocorre por policondensação.
Diferentemente do poliestireno, o poli(dimetilsiloxano) é um líquido de aspecto viscoso, por existirem átomos de oxigênio intercalados com átomos de silício ao longo de toda a molécula. Estes átomos de oxigênio conferem uma maior mobilidade à molécula, permitindo que deslizem umas sobre as outras. O impedimento causado pelas moléculas de CH3 também auxilia neste processo, repelindo as cadeias umas das outras.
Após a reticulação com o ácido bórico, as moléculas de poli(dimetilsiloxano) ficam ligadas umas às outras, diminuindo a fluidez do material, tornando-o um sólido elastomérico com propriedades viscoelásticas bastante pronunciadas.
O desenvolvimento de um processo economicamente atrativo de para os clorosilanos foi descoberto por E. G. Rochow em 1940, no E.G. Research Laboratory, que permitiu a produção de uma larga variedade de produtos de poucos e básicos monômeros. A química básica envolvida no processo direto de Rochow pode ser descrita como:
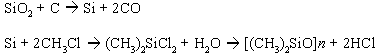
Figura 6 - Síntese comercial do poli(dimetilsiloxano).
Os polímeros podem ser caracterizados de várias maneiras; a mais simples é a observação de seu comportamento ao aquecimento. A altas temperaturas um polímero pode ser um líquido viscoso onde as cadeias moleculares têm alguma mobilidade relativa umas às outras. A baixas temperaturas algumas regiões do polímero podem apresentar estrutura regular característica dos cristais. A fase de transição característica é denominada de ponto de fusão cristalino. Alternativamente, o polímero pode ser amorfo, ou seja, um sólido vítreo a baixas temperaturas onde as cadeias moleculares estão efetivamente estáticas mas não em um padrão regular.
Utilizando-se técnicas calorimétricas adequadas, como a termogravimetria (TGA - Thermogravimetric Analysis) ou a calorimetritria de varredura diferencial (DSC -Differential Scanning Calorimetry) é possível identificar com um considerável nível de confiança um polímero. Os polímeros degradam-se em temperaturas específicas; assim curvas de TGA podem ser empregadas. O termograma de DSC revela as temperaturas e entalpias de fusão características de polímeros cristalinos ou a temperatura de transição vítrea (Tg) de polímeros amorfos, possibilitando também a identificação por comparação com padrões.