Os zeólitos são materiais tecnologicamente importantes e que encontram aplicações em uma série de processos químicos. Sua vasta utilização em petroquímica, na adsorção e na indústria de detergentes tem impulsionado a pesquisa desses materiais a um ponto nunca antes imaginado pelos pioneiros no campo. Mas o que são afinal os zeólitos??
![]()
Por definição, zeólitos são compostos por tetraedros SiO4 e AlO4 conectados pelos átomos de oxigênio dos vértices. A substituição de Si+4 por Al+3 gera uma densidade de carga negativa estrutural que é balanceada por cátions trocáveis (Na+, H+, etc.), assegurando a estabilidade do sólido. É notável a estabilidade térmica conferida aos zeólitos quanto têm cátions de terras raras como contrabalanceadores de carga. Um aluninossilicato é considerado um zeólito quando tem mais de um íon alumínio por cela unitária do material. Quando isso não ocorre, o material é denominado silicalita e a presença do alumínio é considerada uma dopagem. Por outro lado, outros metais representativos com número de oxidação III ou IV podem ser incorporados à estrutura de um silicato. Mais uma vez, se a concentração deste metal for maior que um íon por cela unitária, o material é considerado um metalossilicato zeolítico.
Devido à grande diversificação de composições disponíveis, convencionou-se chamar essa grande família de materiais micro e mesoporosos de peneiras moleculares, abrangendo, mas não eliminando, todas as denominações anteriores.
Uma das principais diferenças entre um zeólito e qualquer outra peneira molecular é o fato de que a estrutura de um zeólito tem que ser obrigatoriamente cristalina, enquanto que a estrutura de outras peneiras moleculares não necessariamente. A outra grande diferença entre um zeólito e uma peneira molecular é que os zeólitos são constituídos apenas por átomos de Si, Al, O e um cátion qualquer, e as peneiras moleculares podem possuir outros elementos em sua constituição, como o fósforo.
Existem
vários tipos de zeólitos naturais, com composições químicas e estruturas
cristalográficas variáveis. Desde 1955, tentativas vêm sendo realizadas no
sentido de preparar zeólitos sinteticamente. Vários já foram preparados,
caracterizados e testados para atividades catalíticas.
Os trabalhos iniciais sobre a síntese de zeólitos foram realizados na divisão da "Linde Union Carbide Corporation" por Breck e colaboradores, que resultou na preparação do zeólito A. As sínteses dos zeólitos X e Y foram patenteadas por Milton em 1959 e por Breck em 1964, respectivamente.
O zeólito A (figura 1) contém quantidades iguais de silício e alumínio. Os poros são formados por anéis de 4, 6 e 8 átomos de oxigênio, sendo a dimensão do maior poro igual a 4,1 Å (1Å=10-10m). Pode ser preparado a partir de aluminato de sódio e silicato de sódio, nantendo a relação Si/Al igual a 1. No início da reação forma-se um gel amorfo que sofre subseqüente transformação no zeólito cristalino. Pequenas amostras são retiradas durante a reação e analisadas através da técnica de difração de raios X. A filtração simples e a lavagem com água produz finalmente o zeólito A.
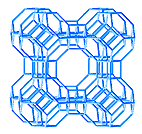
Figura 1 - Estrutura cristalina do zeólito A.
O zeólito A também é chamado de zeólito 3A, 4A ou 5A, dependendo do tipo de metal, alcalino ou alcalino terroso, existente dentro da estrutura básica do aluminossilicato. Os números 3, 4 e 5 representam a dimensão da abertura dos poros em Ângstrons. Quando os íons de sódio são substituídos pelos de potássio, o aluminossilicato resultante é conhecido como zeólito 3A. O íon potássio é maior que o íon sódio e conseqüentemente bloqueia os poros. No zeólito 5A, os íons sódio são substituídos pelos íons cálcio. Os raios iônicos de Ca2+ e Na+ são aproximadamente iguais, mas a quantidade de cátions de cálcio necessária é a metade da quantidade de íons de sódio. Portanto, os poros do zeólito contendo cálcio são maiores que os daquele contendo sódio.
Outra peneira molecular com reconhecida importância industrial é a MCM-41. Sua formação dá-se de acordo com a figura 2:
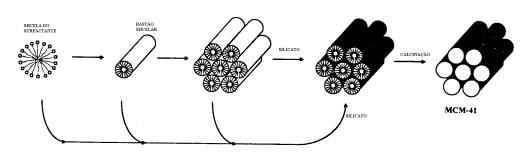
Figura
2 - Formação
da peneira molecular MCM-41
Inicialmente,
o surfactante forma micelas, que se organizam em bastões. Esses bastões
arranjam-se em uma geometria hexagonal de corpo centrado. Quando é adicionado
silicato, o surfactante organizado orienta a formação das cavidades conforme
este arranjo e após a calcinação obtém-se a peneira molecular desejada.
Diferentemente do zeólito A, a peneira molecular MCM-41 não apresenta cristalinidade, fato observado pela espectroscopia de raios-X de ambas as estruturas (figura 3). Enquanto o zeólito A apresenta espectro característico de uma estrutura com razoável grau de organização, a peneira molecular MCM-41, ao contrário, apresenta espectro característico de uma estrutura amorfa.
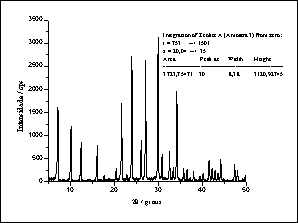

Figura
3 - Comparação entre os difratrogramas de raios-X do Zeólito A e da
peneira molecular MCM-41. Cada pico indica a presença de planos organizados na
estrutura. A ausência de picos no difratograma da peneira molecular MCM-41revela
tratar-se de um material amorfo.
As peneiras moleculares têm vasta aplicação na indústria química, como no craqueamenteo catalítico nos processos petroquímicos, cujo uso foi iniciado em 1960; na conversão de álcoois em hidrocarbonetos, realizada pela primeira vez por Mattox em 1962 e na isomerização de xilenos, produzindo o p-xileno, que é um dos importantes intermediários químicos requeridos em larga escala para produzir fibras sintéticas de poliéster.
A. Krell